La fisica che fa bene

ATTUALITÀ PER LA CLASSE | Fisica
Usare radiazioni ionizzanti opportunamente “addomesticate” dai fisici per danneggiare i tumori: è l’obiettivo della radioterapia, che sta evolvendo verso forme sempre più sofisticate.
Nella foto: il complesso delle macchine acceleratrici del CNAO, Centro Nazionale di Adroterapia Oncologica a Pavia.
Poche conoscenze si sono tanto rapidamente evolute in applicazioni tecnologiche come la scoperta delle radiazioni ionizzanti, effettuata nel 1895 dal fisico tedesco Wilhelm Röntgen e da subito utilizzata in medicina, in ambito diagnostico e terapeutico. Grazie alle molteplici implicazioni in campo sanitario, sociale ed economico, il sodalizio vincente tra la fisica di queste radiazioni e la medicina fornisce molti spunti di riflessione sul ruolo e l’importanza di una scienza dura come la fisica rispetto alla vita quotidiana.
Mi chiamo ionizzante. Radiazione ionizzante
Sotto il nome di radiazioni ionizzanti i fisici classificano una molteplicità di agenti accomunati dalla capacità di produrre ionizzazioni quando attraversano la materia. Quando l’energia della radiazione è superiore a quella che lega un elettrone a un atomo o ad una molecola (circa 30 eV) si innesca un fenomeno detto ionizzazione che porta all’espulsione dell’elettrone e alla produzione di uno ione positivo. Le radiazioni ionizzanti sono chiamate così perché, trasferendo la loro energia agli atomi, generano coppie di ioni. Se prodotte all’interno dei tessuti biologici, a loro volta danno avvio a una cascata di eventi in grado di cambiare la struttura e la funzione delle molecole delle cellule.
Gli agenti 007 della missione radioterapia
Sono radiazioni ionizzanti: le onde elettromagnetiche a partire dai raggi ultravioletti; i costituenti degli atomi, ossia elettroni, protoni e neutroni; gli ioni pesanti come i nuclei del carbonio, dell’elio, dell’ossigeno o del neon privati del tutto o in parte degli elettroni orbitali. Le caratteristiche fisiche della radiazione – se elettricamente carica o neutra – determinano le interazioni fondamentali con cui essa interagisce con la materia – interazione elettromagnetica o nucleare forte – portando a caratteristici modi di trasferimento di energia e quindi di modificazione delle molecole biologiche.
L’anello debole della catena
In particolare, il DNA è la molecola più sensibile che troviamo all’interno di una cellula, poiché è unica e depositaria dell’informazione genetica grazie alla quale ogni cellula si riproduce, cresce e svolge le sue specifiche funzioni.
Inoltre è la molecola più voluminosa, quindi la più facile da colpire in una gara di tiro al bersaglio, ed è molto attiva, essendo coinvolta in processi di duplicazione, trascrizione e sintesi: l’esperienza insegna che tanto più un oggetto si usa, tanto maggiore è la probabilità che si rompa. L’evoluzione, però, ha dotato le cellule di complessi meccanismi atti a sorvegliare l’integrità del DNA e a correggerlo nel caso in cui si verificassero danni che potrebbero portare a un funzionamento non corretto della cellula o alla sua morte. Che cosa c’entra tutto ciò con le radiazioni ionizzanti? C’entra se si prendono in considerazione le cellule tumorali, dove l’efficienza dei meccanismi di riparazione è ridotta, ed è proprio questa differenza tra le cellule malate e quelle sane a venire sfruttata in radioterapia. L’idea è quella di concentrare nelle prime l’effetto delle radiazioni ionizzanti, in modo da indurre un numero così alto di danni al DNA che la cellula non sia più in grado di farvi fronte, forzandola a morire.
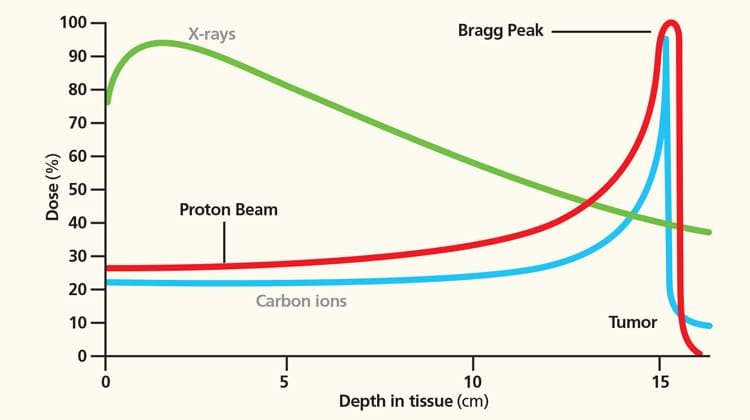
Una questione di precisione
Un concetto molto importante per valutare l’efficacia di una terapia è quello di selettività. Un trattamento è tanto più selettivo quanto più la sua azione si concentra solo sul bersaglio che si vuole silenziare. Nella radioterapia è la fisica dell’interazione tra le radiazioni ionizzanti e la materia a dettare la selettività del trattamento. Osserviamo la figura a fianco, che riporta, in funzione della profondità all’interno del corpo umano, l’energia depositata per unità di massa (grandezza fisica chiamata dose). Trascurando i primi centimetri di tessuto, la curva dei fotoni è asintotica con un profilo esponenziale negativo.
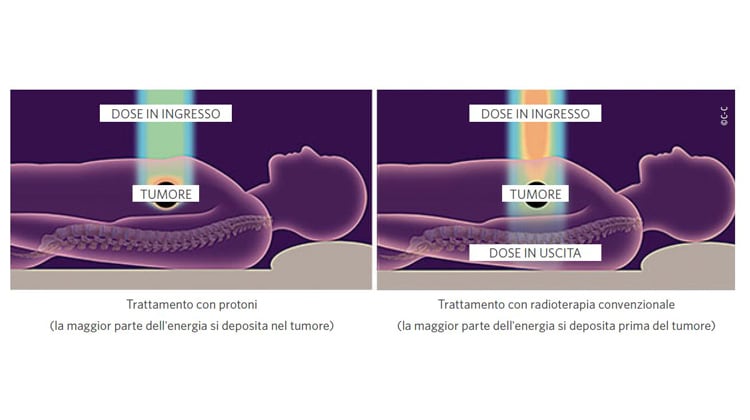
Al contrario, i protoni percorrono uno spessore ben definito, lungo il quale trasferiscono poca energia eccetto che negli ultimi millimetri, dove rilasciano tutta l’energia residua, creando il cosiddetto picco di Bragg. La posizione del picco dipende dall’energia iniziale della particella: maggiore è l’energia, più in profondità si formerà il picco. Queste curve si chiamano profili di dose e forniscono la chiave di lettura per comprendere l’uso delle radiazioni ionizzanti in radioterapia. Nel caso dei fotoni, usati nella radioterapia convenzionale, la forma più comune di radioterapia, il tumore viene trattato – tecnicamente si dice irraggiato – combinando più fasci che entrano nel corpo del paziente da direzioni diverse e tali da intersecarsi nel volume tumorale. Per additività, il tumore riceve una dose Nd, dove d è la dose dovuta al singolo fascio e N è il numero di fasci, mentre i tessuti sani che si trovano nei corridoi di ingresso e uscita dei fasci ricevono solo una frazione della singola dose d. Il trattamento è ancora più selettivo nel caso dell’adroterapia che fa uso dei protoni o degli ioni carbonio. Controllando posizione ed energia iniziale del fascio è infatti possibile muovere il picco di Bragg così da coprire l’intero volume del tumore, depositando solo una piccola frazione della dose nei tessuti sani che precedono il tumore e ignorando completamente quelli posteriori.
Come l’agente Q per James Bond
Diciamoci la verità: l’agente 007 non sarebbe così infallibile e letale nelle sue missioni senza le armi e i sensori ad altissima tecnologia che l’agente Q maschera nei più disparati oggetti di vita quotidiana (orologi da polso, stilografiche, automobili ecc.). Lo stesso binomio è necessario nel caso delle radiazioni ionizzanti: hanno bisogno di conoscenze e tecnologie di supporto che controllino e indirizzino efficacemente le loro potenzialità terapeutiche. La tecnologia necessaria per la radioterapia è essenzialmente quella degli acceleratori di particelle.
Nel caso dei fotoni si usa un acceleratore lineare (LINAC) che accelera elettroni emessi per effetto termoionico fino a farli scontrare su una targhetta di metallo. Nell’urto gli elettroni subiscono forti deviazioni e per l’effetto frenamento emettono fotoni che sono poi indirizzati sul paziente. Nel caso dell’adroterapia, invece, gli ioni vengono accelerati mediante sincrotroni, grandi anelli composti da una successione di LINAC e calamite che rispettivamente accelerano e curvano la traiettoria. Percorrendo l’anello più e più volte, è possibile aumentare l’energia delle particelle fino al valore desiderato. I princìpi appena enunciati sono stati sviluppati e sono alla base di alcuni dei laboratori di fisica fondamentale più importanti al mondo, come il CERN di Ginevra e lo SLAC in California.
Agente 007: uccidere senza lasciar traccia
La radioterapia con fotoni e l’adroterapia sono molto efficaci quando si conoscono posizione e dimensione del tumore. Che fare però quando il tumore è composto da molti, piccoli, noduli sparsi in un organo? O quando la malattia si infiltra come le radici di una pianta nel tessuto sano? In questi casi viene in aiuto un ultimo tipo di radioterapia non convenzionale, chiamata terapia per cattura neutronica con il boro. L’idea è quella di irraggiare uniformemente la regione nella quale si annida il tumore con un fascio di neutroni di bassa energia. Queste particelle da sole non sono in grado di danneggiare significativamente le cellule.
Quando però il neutrone incontra un nucleo di boro-10 (B10), un isotopo non radioattivo dell’elemento boro, è come se si accendesse una miccia. La fisica nucleare infatti insegna che, assorbendo il neutrone, il nucleo del B10 si trasforma in un nucleo instabile che si spacca in due “pezzi” più leggeri, un nucleo di elio e uno di litio. Questi si allontanano l’uno dall’altro di qualche micrometro, distanza coincidente con il diametro medio delle cellule. Se si accende quindi la miccia dentro una cellula tumorale, l’effetto dell’esplosione sarà avvertito solo all’interno di questa cellula, senza interessare quelle sane circostanti. La selettività di questa terapia non dipende tanto dalla precisione nel mirare al tumore con il fascio di radiazioni quanto dalla capacità di accumulare il B10 solo nel tumore. La chimica e la biologia ci vengono in aiuto, individuando le molecole di cui un tumore si nutre (per esempio amminoacidi che servono in grande quantità per produrre nuove copie di cellule malate) e appiccicandovi poi degli atomi di B10. Sorgenti di neutroni sufficientemente intense per la clinica sono ottenute presso i reattori nucleari, ma visti i problemi di sicurezza e gestione di questi impianti, negli ultimi anni si sono sviluppati acceleratori di protoni per la produzione di fasci di neutroni che richiedono tecnologie e hanno dimensioni analoghe a quelle dei LINAC della radioterapia convenzionale.
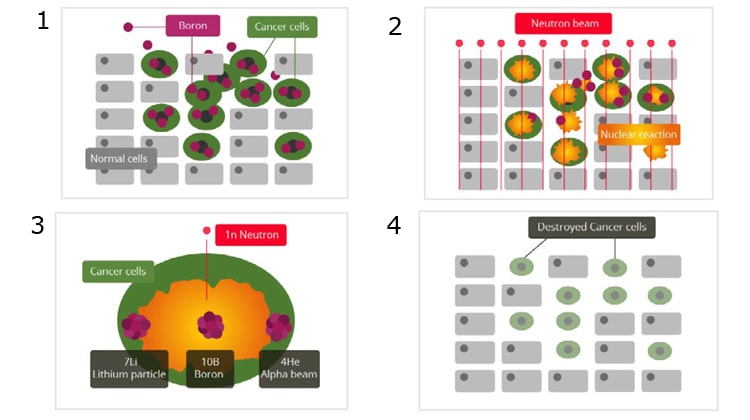
I principi e la selettività della terapia per cattura neutronica con B10
Stadio 1
Prima dell’irraggiamento, le cellule tumorali assorbono la molecola contenente il B10 che viene iniettata nel flusso ematico del paziente.
Stadio 2
Si concentra l’irraggiamento neutronico nella regione dove ha sede il tumore, facendo attenzione che la copertura di tutta la regione sia il più uniforme possibile.
Stadio 3
Zoom della reazione di cattura neutronica che interessa solo le cellule tumorali che hanno accumulato il B10.
Stadio 4
Grazie ai danni molecolari molto gravi prodotti dalle coppie di particelle alfa e ioni litio le cellule tumorali sono state uccise, mentre le cellule sane circostanti sono ancora integre e funzionanti.
Un necessario approccio multidisciplinare
Oggi la radioterapia rappresenta la seconda delle tecniche più utilizzate contro il cancro (superata solo dalla chirurgia) e una componente fondamentale nei protocolli di trattamento dei tumori: a un certo punto della cura, infatti, più del 50% dei pazienti riceve almeno un irraggiamento con radiazioni ionizzanti, considerando solo quelle convenzionali (fotoni). I vantaggi introdotti dalle radiazioni cariche sono attualmente in fase di ricerca e sviluppo per poter sfruttare al massimo le loro proprietà fisiche peculiari. Forti prove sperimentali della migliore efficacia di queste radiazioni sono già state raccolte in gruppi selezionati di pazienti di considerevoli dimensioni: più di 150 000 per l’adroterapia e 450-550 per la BNCT.
Ogni progresso nella conoscenza di base dei tumori e nello sviluppo di nuove tecnologie è una conquista essenziale per rendere il cancro una malattia sempre più curabile. Tutto questo è possibile solo mediante gli sforzi congiunti di medici, biologici e fisici che grazie alle loro conoscenze complementari possono sviluppare strumenti ad altissima precisione contro la malattia.
PER APPROFONDIRE
- Protti N., Io e la fisica, webinar progetto Eureka di Pearson.
- Ramani D., I meccanismi di riparazione del DNA, in Science Magazine n.09, dicembre 2015.
- Wilhelm Conrad Röntgen, The Nobel Prize in Physics 1901, pagina web del premio Nobel dedicato a Roentgen.
- Nuclear Physics for Medicine, documento del Nuclear Physics European Collaboration Committee, 2014.