I meccanismi di riparazione del DNA

ATTUALITÀ PER LA CLASSE | Biologia
Il Nobel per la chimica 2015 ha premiato tre scienziati per le loro scoperte relative ai sistemi di riparazione della molecola di DNA. Meccanismi fondamentali per la cellula, perché guai se gli errori nella sequenza o i danni alla struttura del DNA non venissero riparati. Vediamo di che cosa si tratta esattamente.
Qualcuno li ha definiti come “il kit di pronto soccorso del nostro genoma”. Sono operai straordinariamente solerti, al lavoro 24 ore su 24 per ogni giorno della nostra vita, indefessi nell’aggiustare i danni al nostro DNA. Un vero gruppo di pronto intervento, insomma, efficace nell’accorrere lì dove qualcosa è andato storto per porre rimedio. La scienza li conosce come “meccanismi di riparazione del DNA” ma, se non fosse stato per i premi Nobel per la Chimica 2015 che hanno distinto l’importanza delle scoperte compiute in questo campo da tre scienziati – lo svedese Tomas Lindahl, il turco-americano Aziz Sancar e lo statunitense Paul Modrich – molti non avrebbero mai saputo della loro esistenza. Eppure, in termini di salute e malattia a questo gruppo di processi biologici, alla loro raffinatezza, alla loro velocità, alla loro efficienza, tutti noi dobbiamo molto. Anzi, moltissimo.
Tante minacce per una molecola preziosa
Per capire il perché, dobbiamo spingerci fin dentro il nucleo della cellula, lì dov’è contenuto il nostro genoma, e comprendere le minacce a cui il DNA è costantemente sottoposto. Lo facciamo con l’aiuto di Fiamma Mantovani, ricercatrice dell’Università di Trieste che opera presso il Laboratorio nazionale del Consorzio interuniversitario per le biotecnologie. «Le molte minacce all’integrità della molecola del DNA hanno origini diverse: esterne, come agenti chimici o radiazioni, o interne, per opera di molecole prodotte dallo stesso metabolismo della cellula, per esempio i radicali liberi dell’ossigeno» spiega la scienziata. «Inoltre, alcune alterazioni del DNA possono avvenire spontaneamente e altri errori si possono verificare durante processi specifici, primo fra tutti la duplicazione del DNA nella divisione cellulare.»
Le possibili conseguenze dei danni al DNA
Se non ci fossero i sistemi di riparazione, ogni danno potrebbe dare luogo a una mutazione, ovvero a un cambiamento permanente della sequenza delle basi del DNA, che costituiscono i geni e le sequenze di controllo. Le conseguenze potrebbero essere gravi per la cellula e per l’intero organismo: «Non tutte le mutazioni sono nocive, ma per l’individuo ognuna di esse rappresenta un potenziale pericolo» afferma Mantovani. «Nel caso in cui danni di tipo strutturale (in particolare le rotture della doppia elica di DNA) non siano riparati, la cellula, se non va incontro alla morte, continuerà a vivere con un genoma più instabile, accumulando nuove mutazioni.
Se quella coinvolta è una cellula germinale, uovo o spermatozoo, il danno potrebbe tradursi in una diminuzione della fertilità dell’individuo o in un difetto genetico trasmesso alla prole. Se si tratta di una cellula di un altro tessuto, ancora in grado di moltiplicarsi, questa situazione potrà favorire lo sviluppo e la progressione di tumori.» Per quale ragione? «Se una cellula ha un DNA danneggiato ed è in grado di dividersi trasmetterà il difetto alle cellule figlie. A causa dell’instabilità del genoma, nelle nuove generazioni le mutazioni potranno aumentare, in un processo che, se non arrestato, potrà portare alla trasformazione tumorale: ovvero si assisterà al caso di una cellula che, paradossalmente, proprio grazie ai difetti nel proprio genoma, ha acquisito una capacità di sfuggire a tutti i controlli, di moltiplicarsi all’infinito e sopravvivere ai meccanismi di difesa dell’organismo. Una supercellula, potremmo dire, ma maligna».
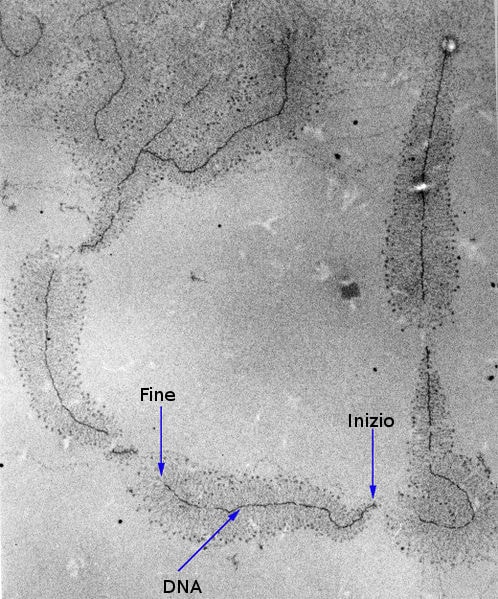
I guardiani del genoma
Ed ecco così emergere prepotente il ruolo dei meccanismi di riparazione del DNA: «Nella cellula esistono componenti che funzionano come guardiani dell’integrità del genoma e lo passano al vaglio di continuo. In caso di errore, lanciano l’allarme, allertando diversi meccanismi, tra cui quelli della riparazione. Alcuni sistemi di riparazione agiscono sempre, addirittura mentre il DNA viene trascritto in RNA, che è il processo base per il trasferimento dell’informazione dai geni al resto della cellula: in effetti, ci dice la ricerca, i geni più attivi sono quelli controllati meglio. Altri sono in funzione solo in determinati momenti della vita cellulare».
La riparazione per escissione di basi
E allora, cominciamo a conoscere questi industriosi aggiustatori del genoma. Per farlo, dobbiamo dividerli in due categorie a seconda che siano coinvolti nella riparazione di alterazioni chimiche della molecola di DNA, oppure di rotture della doppia elica.
Cominciamo dalla prima categoria, sulla quale tra l’altro si sono concentrate le ricerche degli scienziati premiati con il Nobel.
Il primo meccanismo, individuato dallo svedese Tomas Lindahl, si chiama riparazione per escissione di basi (BER). «Le ricerche di Lindahl hanno mostrato che il DNA è naturalmente instabile anche in assenza di agenti chimico-fisici esterni. Insomma può danneggiarsi senza causa apparente.» A farne le spese, in particolare, sono le basi azotate che costituiscono l’acido nucleico, timina, citosina, adenina e guanina: alcune fra loro possono andare incontro spontaneamente a un’inopportuna modificazione. «Lindahl ha scoperto che grazie al BER questi danni sono riparati per intervento di una serie di enzimi che eliminano prima la base errata e poi il nucleotide di cui fa parte e quindi lo sostituiscono con quello corretto» spiega la ricercatrice.

La riparazione per escissione di nucleotidi
Il secondo meccanismo, noto con il nome di riparazione per escissione di nucleotidi (NER) e scoperto da Aziz Sancar, è in qualche modo simile al primo ma coinvolge più nucleotidi alla volta – i nucleotidi sono le unità ripetitive di DNA e RNA, composte da uno zucchero, da un gruppo fosfato e da una delle 4 basi azotate – riparando danni lunghi dai 2 ai 30 nucleotidi. «Un esempio del suo funzionamento? Quando, per colpa delle radiazioni ultraviolette, si assiste alla formazione di un legame sbagliato tra due basi di timina presenti vicine sullo stesso filamento di DNA, il sistema NER rimuove il pezzo di DNA contenente l’errore e lo sostituisce con uno corretto.»
Il meccanismo di mismatch repair
Il terzo meccanismo, per cui è stato premiato Paul Modrich, è quello definito mismatch repair (MMR). Il suo compito è correggere l’inserzione errata di basi nella catena in formazione che si può verificare durante la duplicazione del DNA, operazione che anticipa la divisione cellulare: «Di per sé – spiega Mantovani – il meccanismo di duplicazione fa pochissimi errori, poiché è dotato di un efficiente sistema di “correzione delle bozze”. Tuttavia, nella cellula la tolleranza nei confronti degli errori di copiatura è bassissima, e il sistema è ulteriormente raffinato proprio dal meccanismo del MMR, un apparato di controllo che porta il livello finale di errore a 1 ogni miliardo di nucleotidi».
Riparazioni sul posto
A questi tre meccanismi principali, definiti di “riparazione per escissione” in quanto comportano l’eliminazione e la sostituzione di materiale genetico, se ne aggiungono altri, in cui i nucleotidi danneggiati vengono riparati in loco, senza che ci sia alcuna sostituzione. È questo l’esempio dell’azione di un enzima chiamato MGMT (O-6-metillguanina-DNA metilltransferasi), incaricato di rimuovere specificamente alterazioni chimiche a carico di una delle basi azotate, la guanina.
Quando si rompono i filamenti
Non è tutto. Come anticipato, infatti, esiste una seconda categoria di meccanismi di riparazione che entrano in azione quando avvengono vere e proprie rotture a carico di uno solo o di entrambi i filamenti del DNA. Spiega Mantovani: «Le rotture della doppia elica sono molto pericolose soprattutto quando avvengono contemporaneamente su entrambi i filamenti del DNA (fenomeni noti con il nome di Double-Strand Breaks, DSB), perché potrebbero portare a cambiamenti strutturali del genoma molto severi. Le cellule possiedono una complessa risposta a questo tipo di eventi che non solo porta alla riparazione del danno, ma assicura che la cellula non possa continuare i suoi normali processi con lesioni di questo tipo. Il pericolo di una trasformazione tumorale, infatti, sarebbe troppo elevato».
La ricombinazione omologa
I meccanismi di riparazione di DSB noti sono due. Il primo si chiama ricombinazione omologa (HR) e può agire soltanto in alcune fasi del ciclo cellulare, in particolare durante o successivamente alla duplicazione dei cromosomi in vista della divisione cellulare. Per correggere in maniera fedele il doppio filamento danneggiato, questo sistema richiede la presenza di una sequenza identica o molto simile che possa essere usata come stampo. Per questa funzione l’apparato utilizza il cromosoma omologo, ossia l’altra copia – perfettamente intatta – del cromosoma danneggiato presente all’interno del nucleo, oppure il cromatidio fratello appena sintetizzato nel processo di duplicazione del DNA. Grazie all’azione di diversi enzimi e con uno stampo corretto, il danno può così essere riparato efficacemente.
La giunzione non omologa delle estremità
In caso di rottura dei due filamenti in altri momenti della vita cellulare, invece, il protagonista è un secondo processo, definito giunzione non omologa delle estremità (NHEJ). Racconta Mantovani: «Rispetto alla precedente, è un’alternativa molto meno fedele e accurata. Anzi, potremmo definirla una specie di roulette russa perché i sistemi enzimatici sono costretti a riparare la doppia elica senza uno stampo a garantire la correttezza dell’intervento.
Questi complessi legano i due filamenti in assenza di un modello di riferimento, possibilmente basandosi su un limitato appaiamento tra basi tra un’elica di DNA e l’altra. Con questo riconoscimento tra brevi sequenze omologhe, il doppio filamento viene ricostituito. Come si può capire, però, se da un lato si tratta di un rimedio indispensabile per la cellula, risulta essere anche molto grossolano, e quindi fonte, a sua volta, di possibili errori anche gravi».
Sistemi di allarme, sistemi di riparazione e malattie
Conoscere in dettaglio i meccanismi di riparazione del DNA ha permesso di far luce sull’origine di molte patologie. Un difetto nel sistema NER è per esempio alla base di una malattia genetica chiamata Xeroderma pigmentoso, caratterizzata da un’elevata fotosensibilità e un’ipersensibilità ai raggi UV, con un rischio molto elevato di sviluppo di cancro della pelle. Alla base di un’altra malattia, il cancro al colon ereditario non poliposico, invece, c’è un difetto nei geni coinvolti nel meccanismo del mismatch repair. Una mutazione ereditaria in uno dei geni coinvolti nel processo della riparazione omologa (in particolare i geni BRCA1 e BRCA2) portano a una predisposizione allo sviluppo del cancro al seno e all’ovaio. È una condizione portata all’attenzione dall’attrice Angelina Jolie, che ha scelto di sottoporsi a un intervento radicale di asportazione delle mammelle e delle ovaie in quanto portatrice di una mutazione del gene BRCA1, responsabile dello sviluppo di tumori mortali in alcuni membri della sua famiglia.
Commenta Fiamma Mantovani: «Come si vede da questi esempi, i difetti nei geni che promuovono la riparazione sono alla base della predisposizione allo sviluppo di diversi tipi di patologie e di cancro a carattere ereditario. Per quanto riguarda i tumori spontanei, invece, bisogna fare un discorso diverso. In questi casi, anche se le mutazioni rimangono protagoniste della trasformazione tumorale, non è un difetto a carico dei sistemi di riparazione a favorire lo sviluppo della malattia ma, come si è scoperto in anni recenti, qualcosa che sta a monte. Ossia un’anomalia nei geni deputati al controllo dell’integrità del genoma». Facendo di nuovo ricorso alle metafore, mentre nelle sindromi ereditarie il problema sta nella squadra di soccorso, nei casi dei tumori spontanei, la squadra di riparatori funziona ancora ma è rotta la sirena deputata ad avvertirli del pericolo e della necessità di intervenire.
Dalla ricerca alla clinica
Note le cause, queste conoscenze potranno essere utili in futuro per mettere a punto nuove cure? «In realtà, esiste già un approccio utilizzato in pratica clinica che sfrutta proprio queste nozioni. Sono i cosiddetti inibitori di PARP, molecole approvate per la cura del tumore all’ovaio con mutazioni nel gene BRCA.
Questi farmaci vanno a colpire le cellule tumorali che hanno difetti di funzionamento del processo di riparazione omologa». Gli inibitori di PARP bloccano l’azione degli enzimi Parp, molecole coinvolte nella riparazione delle rotture al singolo filamento di DNA. Nelle cellule tumorali, l’impossibilità di riparare il singolo filamento causata dal farmaco porta come conseguenza l’aumento di rotture nel doppio filamento, che non possono essere corrette perché, come detto, in queste cellule il meccanismo di riparazione omologa non funziona. Le cellule sane, nelle quali invece questo meccanismo è ancora attivo, sopravvivono.
Conclude Mantovani: «Si tratta di un approccio molto importante nell’ottica di sviluppare terapie anticancro mirate, che colpiscano selettivamente un “tallone d’Achille” delle cellule tumorali minimizzando gli effetti collaterali a carico degli organi sani. Ed è anche la dimostrazione, una volta di più, che proseguire nella ricerca per comprendere i meccanismi molecolari più profondi del nostro genoma è un’azione indispensabile e assai fertile per la messa a punto di cure sempre più mirate ed efficaci».
PER APPROFONDIRE
Una serie di video didattici (in inglese) di Study.com, con tanto di test da superare per proseguire nella visione:
- Sui danni del DNA, riparazione diretta dei danni, BER e NER
- Sul mismatch repair
- Sui Double Strand Breaks
- Sugli agenti mutageni
- Sull’effetto delle radiazioni
- Su mutazioni puntiformi, delezioni e inserzioni
Altri video, sempre in inglese, da Oxford Academic: