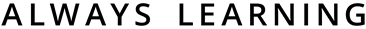Il viaggio delle cellule tumorali

ATTUALITÀ PER LA CLASSE | Biologia
Per nostra fortuna, la formazione di metastasi non è un processo così semplice, perché prevede un viaggio lungo e irto di ostacoli. In questo articolo ne ripercorriamo le tappe.
Superare barriere ed evitare controlli, infiltrarsi tra le maglie di una fitta rete e resistere a vortici travolgenti, e ancora sgusciare attraverso spazi angusti: tutto per riuscire a sopravvivere e andare avanti. Non si tratta della trama di un film d’azione, ma del difficile e tortuoso percorso che le cellule tumorali intraprendono dal luogo nel quale si sono formate – il tumore primario – a un altro punto dell’organismo, dando origine a una metastasi. Un viaggio lungo, complesso, irto di ostacoli e, per nostra fortuna, molto inefficiente: gli studi più recenti mostrano come meno dello 0,01% delle cellule tumorali che lasciano il tumore primario sia in grado alla fine di colonizzare un altro tessuto. Quando ci riescono, però, iniziano i problemi: la formazione delle metastasi è uno degli aspetti più complicati e preoccupanti della malattia tumorale, poiché è responsabile di circa il 90% della mortalità per cancro. È proprio su questo aspetto che si concentrano gli sforzi della ricerca oncologica: comprendere le basi molecolari e cellulari della formazione delle metastasi è fondamentale per riuscire a sviluppare strategie che impediscano o blocchino questo processo.
Ma quando inizia il viaggio delle cellule tumorali e quante tappe prevede? Quali ostacoli incontrano le cellule sul proprio cammino? E quali sono i loro compagni di viaggio?
Prima tappa: l’invasione locale
Nel corso della formazione e dello sviluppo di un tumore le cellule neoplastiche continuano ad accumulare mutazioni che permettono loro di acquisire nuove caratteristiche, come la capacità di proliferare più velocemente delle altre o quella di continuare a crescere anche quando nell’ambiente in cui si trovano non ci sono i segnali giusti per farlo. Tra le varie mutazioni che si possono verificare, ce ne sono alcune che consentono a certe cellule di muoversi meglio: è questo ristretto gruppo di cellule tumorali a iniziare il viaggio.
Se immaginiamo di trovarci in un tumore di un tessuto epiteliale come la pelle o l’epitelio che riveste internamente il nostro intestino, la prima barriera che le cellule tumorali devono superare è rappresentata dalla membrana basale, una struttura di sostegno sulla quale poggiano le cellule epiteliali stesse. Attraversandola, le cellule si spingono verso gli strati più interni del tessuto (lo stroma) fino a raggiungere i vasi sanguigni e quelli linfatici. Per compiere questo primo tragitto, le cellule tumorali hanno bisogno di crearsi dei varchi tra le strutture dello stroma. Ci riescono in vari modi, per esempio aumentando la produzione di metalloproteasi, proteine che degradano le strutture fibrose dello stroma, oppure perdendo sempre più le proprie caratteristiche epiteliali (in virtù di variazioni del proprio programma genetico) per conquistarne altre, tipiche di cellule – dette “mesenchimali” – che migrano di più e meglio.
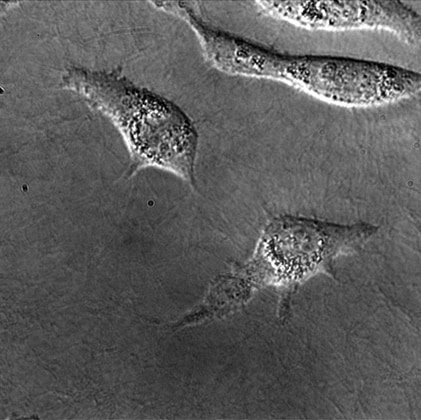
Seconda tappa: l’ingresso nei vasi
L’ingresso nella rete vascolare è noto in inglese anche come intravasation. Per attraversare la parete dei vasi, le cellule tumorali distruggono temporaneamente le giunzioni che saldano tra di loro le cellule endoteliali, cellule che rivestono il vaso stesso sostenendolo e allo stesso tempo permettendo di regolare gli scambi tra il lume del vaso e l’ambiente circostante.
Entrate nel torrente circolatorio, le cellule tumorali sono soggette a diversi tipi di stress, visto che si trovano in un microambiente completamente diverso da quello nel quale si sono generate. Sottoposte alla corrente del flusso ematico, che le schiaccia e le deforma, devono imparare a sopravvivere in sospensione e ad evitare gli attacchi del sistema immunitario. L’impatto del flusso circolatorio e l’azione delle cellule del sistema immunitario (soprattutto le cellule natural killer) contribuiscono a eliminare più del 99% delle cellule tumorali circolanti.
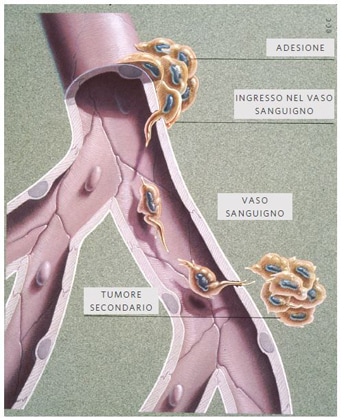
Terza tappa: l’uscita dai vasi
Solo pochissime cellule tumorali riescono ad ancorarsi alla superficie interna dei vasi e ad attraversarne, per la seconda volta, la parete. Questo processo è noto anche come extravasation. Il fenomeno avviene generalmente a livello dei capillari, che avendo un calibro più piccolo degli altri vasi riescono in qualche modo a intrappolare le cellule in viaggio. In un secondo momento, proprio per il fatto di essersi fermate nel letto capillare, le cellule tumorali iniziano a interagire con quelle endoteliali dell’organo in cui sono arrivate. Questa interazione avviene tra alcune proteine presenti sulla superficie delle cellule tumorali (i ligandi) e specifici recettori sulle endoteliali. Si tratta di proteine normalmente coinvolte nei processi di adesione cellula-cellula o cellula-matrice extracellulare, come le integrine e le caderine oppure di molecole coinvolte nell’infiammazione, come le chemochine. È dunque questa specificità d’interazione tra ligandi e recettori a “indicare” alle cellule tumorali dove è possibile riattraversare la parete vascolare e terminare il viaggio.
Come avviene l’extravasation? La maggior parte delle cellule tumorali passa negli interstizi tra una cellula endoteliale e l’altra, distruggendo temporaneamente le giunzioni cellulari e sgusciando tra gli spazi stretti che si ricavano.
Quarta tappa: le micro-metastasi
Raggiunto il nuovo tessuto, le cellule tumorali possono entrare in uno stato di latenza, la dormienza, che può durare anche anni, oppure proliferare, dando luogo a micro-metastasi locali. La maggior parte di esse, tuttavia, va incontro a morte cellulare per l’incapacità di adattarsi alle caratteristiche del nuovo microambiente.
Fine del viaggio: la formazione di metastasi
La quinta e ultima fase del processo di disseminazione metastatica è la colonizzazione dell’organo bersaglio, che avviene quando alcune micro-metastasi cominciano a proliferare in maniera sostenuta e a formare masse tumorali di dimensioni macroscopiche.
La teoria del seme e del suolo
Nel 1889 il chirurgo inglese Stephan Paget evidenziò per primo un legame tra tumore primario e metastasi. Paget analizzò i risultati delle autopsie di oltre settecento donne che avevano sviluppato un cancro al seno e notò che esse avevano tumori anche in altri organi. Non tutti, però, erano colpiti allo stesso modo: le metastasi, infatti, erano più frequenti nel fegato, nell’ovaio e in alcune ossa, mentre erano più rare nella milza. Questa scoperta gli consentì di formulare l’ipotesi nota con il nome di seed and soil valida ancora oggi: come i semi per germogliare hanno bisogno di un terreno adeguato, così le cellule tumorali riescono a generare metastasi solo in alcuni organi.
Oggi sappiamo che è l’interazione tra le cellule tumorali e quelle endoteliali a determinare dove le metastasi si sviluppano e che le cellule tumorali aderiscono preferenzialmente alla rete capillare del proprio organo bersaglio.
Il ruolo del microambiente
La migrazione tumorale è un fenomeno molto dinamico: le cellule tumorali sono influenzate continuamente dall’ambiente nel quale si trovano. Una delle grandi scoperte degli ultimi decenni è proprio l’aver compreso che il microambiente non è un ospite passivo nel quale si sviluppa il tumore. Il continuo scambio di segnali tra cellule tumorali e microambiente influenza reciprocamente l’uno e le altre e ha effetti su come si sviluppa il tumore. Per esempio, si è scoperto che le cellule tumorali riescono a “percepire” la rigidità della matrice extracellulare: più la matrice è rigida, per la presenza di fibre spesse e di molte connessioni tra loro, più le cellule ne sono attratte e si muovono nella sua direzione. Le cellule tumorali, mentre si muovono, mostrano una tendenza ad allinearsi lungo strutture prestabilite, come le fibre di collagene o i vasi sanguigni o addirittura le fibre muscolari. È come se le cellule tumorali si servissero di autostrade già pronte e già normalmente impiegate da altre cellule per i loro spostamenti all’interno dell’organismo. È il caso del melanoma, le cui cellule migrano collettivamente in modo molto veloce, formando lunghe file, e seguendo la via tracciata dalle fibre muscolari, per loro natura particolarmente strette e allungate.
Quando invece si trovano in altri tessuti, come quelli ricchi di cellule adipose, si muovono in gruppi più ampi e disorganizzati, con diversi fronti, per cui ne deriva un movimento più sparso, lento e meno efficace.
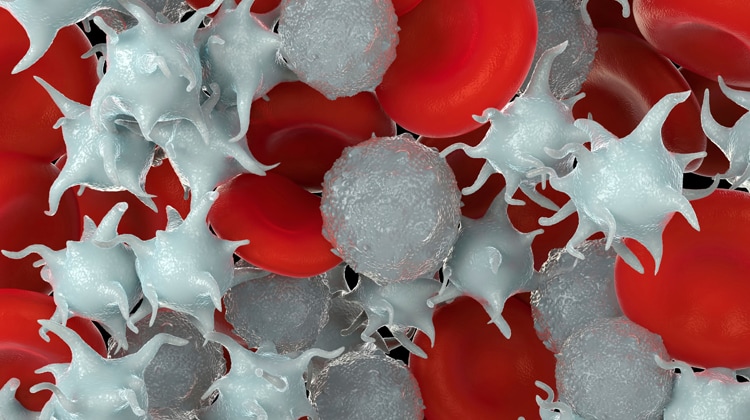
Insoliti alleati
Non appena entrano nel torrente circolatorio, le cellule tumorali sono circondate dalle piastrine, che le avvolgono formando degli aggregati. Questo provoca due effetti: protegge le cellule tumorali dell’azione del sistema immunitario e favorisce l’adesione delle cellule tumorali alla parete dei vasi. Da un lato, infatti, le piastrine secernono molecole che migliorano l’ancoraggio delle cellule tumorali alla parete dei vasi; dall’altro, richiamano globuli bianchi (in particolare i neutrofili), che tramite l’azione di molecole proinfiammatorie come le citochine, facilitano ulteriormente questa adesione. Le piastrine hanno un ruolo importante nell’uscita delle cellule tumorali dal torrente circolatorio, tanto che in alcuni modelli animali la riduzione dei loro livelli inibisce la formazione di metastasi.

Dove sta andando la ricerca?
Se da una parte la ricerca si concentra sulle interazioni tra cellule tumorali e microambiente, dall’altra si sta focalizzando anche sull’implementazione delle tecnologie che consentono di seguire e studiare il processo di disseminazione metastatica in tempo reale nei modelli sperimentali (per esempio topi). Non solo, altri sforzi sono tesi verso l’identificazione di nuovi marcatori molecolari che possano predire lo sviluppo delle metastasi in un particolare organo e sui meccanismi molecolari che regolano il fenomeno dell’extravasation per cercare di ridurre la capacità delle cellule tumorali di uscire dalla rete vascolare e di colonizzare gli organi bersaglio.

Alla ricerca di marcatori molecolari
Un intricato puzzle: così può essere definito il processo di formazione delle metastasi, e di recente il team di scienziati diretto da Giorgio Scita presso l’IFOM di Milano ha aggiunto una nuova tessera al puzzle. Studiando centinaia di campioni di pazienti affetti da tumore al seno, gli scienziati hanno scoperto un legame tra i livelli di espressione di RAB2A, una proteina coinvolta nel traffico cellulare, e la probabilità di sviluppare metastasi. Più i livelli di RAB2A nel tumore primario sono alti, maggiore è la probabilità di sviluppare metastasi. Questo dipende dalla capacità di RAB2A di dirigere verso la membrana proteine e fattori capaci di modificare l’assetto della matrice extracellulare, come la metalloproteasi MT1-MMP. Una scoperta che mostra come fenomeni apparentemente distanti tra loro siano correlati e che apre la strada allo studio di RAB2A come marcatore predittivo dello sviluppo di metastasi.
PER APPROFONDIRE
- Clark A.G. e Vignjevic D.M., Modes of cancer cell invasion and the role of the microenvironment, in Curr Opin Cell Biol, 2015, vol. 36, pp. 13-22.
- Dell H., Seed and soil hypothesis. Observations from a ploughman, in Nature Milestones Cancer, 2006.
- Metastasi, le domande più frequenti, materiale di approfondimento di AIRC.
- Promuovere la migrazione e l’invasione dei tessuti, minipillola video di YouScientist, IFOM.